Шов апоневроза при закрытии лапаротомной раны: выбор материала и оперативная техника
ШОВ АПОНЕВРОЗА ПРИ ЗАКРЫТИИ ЛАПАРОТОМНОЙ РАНЫ: ВЫБОР МАТЕРИАЛА И ОПЕРАТИВНАЯ ТЕХНИКА
А.Л. Владыкин
APONEUROSIS SUTURE FOR CLOSING A LAPAROTOMIC WOUND: CHOICE OF MATERIAL AND SURGICAL TECHNIQUE
Аннотация
Представлен систематизированный обзор, включающий особенности репаративных процессов апоневроза передней брюшной стенки и факторов, влияющих на заживление лапаротомной раны. Обсуждаются различные методики закрытия лапаротомной раны, выбор шовного материала и технические аспекты формирования швов апоневроза. Рассматриваются современные методики временного закрытия лапаротомной раны, закрытие троакарных ран.
Abstract
A systematic review is presented, including the features of the reparative processes of the aponeurosis of the abdominal wall and factors affecting the healing of the laparotomic wound. Various techniques for closing a laparotomic wound, the choice of suture material and technical aspects of the formation of aponeurosis sutures are discussed. The modern techniques of temporary closure of laparotomic wounds and closure of trocar wounds are considered.
Оглавление:
Особенности анатомии и репарации апоневроза белой линии
Выбор хирургической нити для шва апоневроза
Техника шва апоневроза
Закрытие троакарных ра
Временное закрытие лапаротомной раны при перитоните
Список литературы
Ушивание лапаротомной раны является в подавляющем большинстве случаев стандартной процедурой, детально описанной в учебниках по оперативной хирургии и нередко осуществляемой уже не самим оперирующим хирургом, а его ассистентами, нередко – клиническими ординаторами. Однако само разнообразие существующих методик соединения краев операционной раны, периодически возобновляемая дискуссия о преимуществах узловых или непрерывных швов, появившиеся возможности использования абсорбируемого шовного материала для шва апоневроза и, самое главное, сохраняющийся стабильным на протяжении десятилетий уровень раневых осложнений говорят о том, что обсуждение «банальной» темы закрытия операционной раны весьма далеко от завершения.
Особенности анатомии и репарации апоневроза белой линии.
Белая линия живота постоянно находится в поле зрения хирургов, так как большинство операций на органах брюшной полости осуществляется через срединные разрезы. За явные преимущества срединной лапаротомии в плане экспозиции и свободы манипуляций на органах живота довольно часто приходится расплачиваться впоследствии возникновением осложнений со стороны передней брюшной стенки: частота послеоперационных вентральных грыж составляет в среднем 12%, в 80% случаев послеоперационные вентральные грыжи возникают именно после срединных лапаротомий. Ряд авторов утверждает, что на самом деле формированием послеоперационной вентральной грыжи заканчивается каждая пятая срединная лапаротомия [6,11,18,19,32]. Эвентрация по-прежнему относится к одному из наиболее опасных осложнений в абдоминальной хирургии и развивается у 0,5–7,5% пациентов. Частота рецидива эвентрации составляет в среднем 12,5%. При развитии эвентрации в гнойную рану летальность достигает 40%-65% [2-4,9,10,11,21,33].
Среди хирургов существует убеждение, что белая линия живота является всего лишь линией сращения апоневрозов шести контралатеральных боковых мышц (наружной и внутренней косых, поперечной) и характеризуется скудным кровоснабжением. В то же время современные анатомические исследования утверждают, что белая линия живота – это соединительнотканный комплекс со сложной архитектоникой, который состоит из перекрещивающихся и переходящих на противоположную сторону сухожильных пучков апоневрозов трех пар боковых мышц и рыхлой жировой клетчатки, содержащей густую кровеносную сеть (рис. 1). Причем сосудистая сеть состоит как из продольно идущих кровеносных сосудов, так и из сосудов, идущих поперечно. В этой связи очевидно, что при захватывании в шов краев апоневроза происходит сдавление продольных кровеносных сосудов, что приводит к нарушению перфузии тканей и несомненно влияет на нарушение репаративных процессов в ране апоневроза [3,6,8,17,19,22,33].
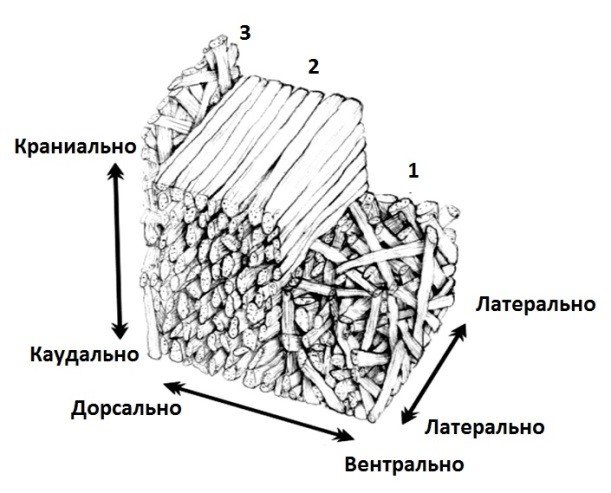 Рис. 1. Архитектоника волокон в апоневрозе белой линии живота: 1 – зона косых волокон, 2 – зона поперечных волокон, 3 – зона с неупорядоченным расположением волокон (Grassel D. et al., 2005).
Рис. 1. Архитектоника волокон в апоневрозе белой линии живота: 1 – зона косых волокон, 2 – зона поперечных волокон, 3 – зона с неупорядоченным расположением волокон (Grassel D. et al., 2005).
Заживление апоневроза, как и заживление любой ткани, проходит стадию воспаления (0-5 день), этап миграции фибробластов (3-5 день), стадию развитие фибробластов и начало продукции коллагена (5-8 день). Далее происходит усиление продукции коллагена (7-14 день) и, наконец, ремоделирование коллагена (с 14 дня). Полный процесс «созревания» рубца длится около года. Апоневротическая ткань заживает значительно медленнее других тканей, к тому же белая линия живота постоянно находится под действием сил боковых мышц, стремящихся «растянуть» формирующийся рубец. Помимо этого на восстановление структурной целостности апоневроза влияет, причем влияет негативно, целый ряд факторов, среди которых наиболее значимыми являются послеоперационный раневые гнойный осложнения, системная дисциркуляция, макро- и микроангиопатия, хроническая интраабдоминальная гипертензия, врожденный дисмезенхимоз, качество формирования шва. В этой связи сегодня уже не удивительным представляется экспериментально обоснованное утверждение D.M. Douglas (1949) о том, что даже сформированный рубец апоневроза никогда по прочности не будет таким же, как до его рассечения [17].
В 2008 году M.G. Frantz продемонстрировал взаимосвязь между качеством шва апоневроза и формированием в последующем вентральной грыжи. После наложения швов в области соприкосновения краев апоневроза формируется «первичный матрикс», который подвергается постоянному механическому растяжению за счет работы косых мышц живота. Прочность этой зоны обуславливается только швом и нитью, которой был сформирован данный шов. Если в течение 1 месяца ширина данной зоны больше 12 мм, то вероятность формирования грыжи составляет 94%, в то время как, если данный показатель меньше 12 мм, частота формирования грыжи составляет лишь 5% [19]. Данные, представленные M.G. Frantz, вполне категорично указывают на роль шва и важность выбора оптимального способа ушивания апоневроза брюшной стенки в профилактике формирования послеоперационной грыжи.
Выбор хирургической нити для шва апоневроза.
Качества шва апоневроза определяется одновременным и взаимосвязанным влиянием двух факторов – применяемым шовным материалом и способом формирования шва. Влияние хирургических нитей на развитие осложнений со стороны послеоперационной раны, как инфекционного, так и неинфекционного характера, в настоящее время доказано и не вызывает сомнений. Такие свойства нити как фитильный эффект (мультифиламенты), травмирование стенок прокольного канала (крученые и плетеные нити с многоразовыми иглами), биологическая несовместимость (нити природного происхождения), а также неабсорбируемость являются своего рода катализаторами острого инфекционного процесса и, в последнем случае, матрицей для формирования хронических очагов инфекции в послеоперационной ране. Если с профилактикой острого гнойно-воспалительного процесса в ране при формировании шва брюшины, мышц подкожной клетчатки и кожи все представляется вполне логичным (для устранения негативной роли шовного материала следует применять афитильные комплексные или монофиламентные, атравматичные, абсорбируемые и антисептические нити), то возможности неспецифической и специфической профилактики острого гнойного процесса и, тем более, предупреждения формирования хронического гнойного очага в области шва апоневроза представляются значительно менее однозначными.
Главная причина этой «неоднозначности» заключается в том, что для решения поставленной задачи (шов апоневроза) необходим малоконтаминируемый монофиламентный и абсорбируемый шовный материал (нет нити – нет лигатурного абсцесса). С другой стороны до недавнего времени все абсорбируемые нити были либо мультифиламентами, либо (что более существенно) обладали короткими сроками абсорбции, недостаточными для поддержания краев апоневроза в соединенном состоянии до восстановления необходимого уровня его прочности. Поэтому даже при использовании на всех этапах вмешательства абсорбируемых нитей при шве апоневроза в лучшем случае применяли полиэстеровую нить в оболочке (чаще – простой мультифиламентный полиэстер или полиамид). До сих пор очень немногие хирурги используют для ушивания раны апоневроза полипропилен. Несмотря на то, что полипропиленовая нить лишена многих недостатков лавсана и, тем более, капрона, она (хоть и в значительно меньшей степени) также подвержена микробной контаминации и способна стать эпицентром лигатурного абсцесса [2-4,9,12,20,21,25,30,32].
Проблема выбора нити для шва апоневроза оставалась в тупике вплоть до появления в клинической практике монофиламентных нитей с длительным сроком абсорбции из полидиоксанона (PDS II, PDS Plus, Monoplus) и из полигидроксибутирата (Monomax). Спустя две недели от момента имплантации в ткань нити из полидиоксанона теряют 25% прочности, спустя четыре недели – 30% прочности и спустя шесть недель – 50% прочности. Полная потеря прочности и абсорбция нитей происходит в период 180 – 210 суток после имплантации [3,14,25,28].
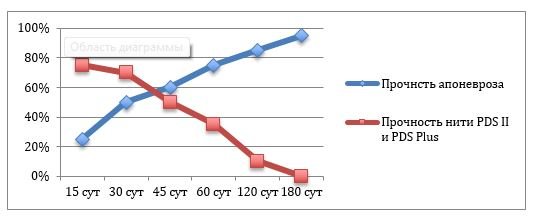 Рис. 2. Сопоставление динамики восстановления прочности апоневроза мышц передней брюшной стенки и абсорбции нитей PDS II и PDS Plus (антисептическая нить с триклозаном).
Рис. 2. Сопоставление динамики восстановления прочности апоневроза мышц передней брюшной стенки и абсорбции нитей PDS II и PDS Plus (антисептическая нить с триклозаном).
При сопоставлении сроков абсорбции нити из полидиоксанона и динамики восстановления прочности апоневроза мышц передней брюшной стенки (рис. 2) становится очевидным, что в «критический» период восстановления 50-60% своей прочности (30 – 45 сутки), необходимых для предотвращения эвентрации и формирования рубца, сохраняется 70-50% прочности нитей из полидиоксанона. Впоследствии, по достижении прочности апоневроза, приближающейся к исходным значениям, нить исчезает из ткани, тем самым переставая являться субстратом имплантационного инфицирования и связанных с ним осложнений. Именно в этом заключается принципиальное различие концепции применения для ушивания раны апоневроза шовного материала с длительным сроком абсорбции от обыденного использования неабсорбируемых нитей (нейлон, капрон, лавсан и даже полипропилен). Безусловно, внешняя оболочка комплексных полифиламентных неабсорбируемых нитей закономерно уменьшает их травматичность и фитильный эффект. Однако с течением короткого времени (2-3 недели) наружная оболочка исчезает и комплексная нить превращается в обычный полифиламент с его потенциально негативным влиянием на течение раневого процесса [3,4,30,31].
Отдельные попытки использования для ушивания апоневроза абсорбируемых нитей (кетгут, производные полигликолевой кислоты) предпринимались уже сравнительно давно, но были оставлены вследствие высокой частоты возникновения эвентраций и послеоперационных вентральных грыж. Это закономерно, поскольку срока потери 50% прочности полигликолидов (3 недели) и, тем более, кетгута (1 неделя) явно недостаточно для поддержания краев апоневроза до достижения его рубцом необходимой прочности. Ряд серьезных исследований по изучению перспектив применения длительно абсорбируемого материала для шва апоневроза был начат лишь в 1980-х годах с появлением нитей из полидиоксанона (PDS и Maxon). Данные исследования заложили основу для выбора шовного материала и методики формирования шва апоневроза с точки зрения доказательной медицины [28].
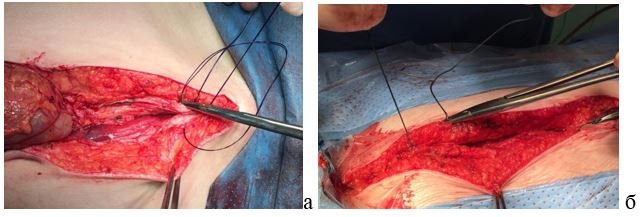 Рис. 3. Шов апоневроза белой линии: а - нитью-петлей PDS Plus 0; б - нитью Ethibond Excel 0.
Рис. 3. Шов апоневроза белой линии: а - нитью-петлей PDS Plus 0; б - нитью Ethibond Excel 0.
В исследованиях, посвященных сравнительной оценке неабсорбируемых и абсорбируемых нитей для шва апоневроза, сопоставлялся разный шовный материал при одинаковой технике ушивания (как непрерывным швом, так и отдельными швами). В исследовании J.Wissing (1987) сравнивался непрерывный шов из быстро абсорбируемого материала (Vicryl) с непрерывным швом из неабсорбируемого материала (Ethibond) на 751 пациентах. При этом случаи возникновения послеоперационных грыж в течение первых трех лет наблюдения регистрировались достоверно чаще после наложения рассасывающихся швов. Тем не менее, у пациентов, которым накладывался шов из неабсорбируемого материала, значительно чаще формировались лигатурные свищи и дольше беспокоили боли в зоне послеоперационной раны. В этом же исследовании также сравнивались непрерывные швы из материала со стандартным сроком абсорбции (Vicryl) с непрерывными швами из медленно абсорбируемого материала (PDS). В результате было обнаружено, что в первом случае, частота случаев с послеоперационной грыжей была достоверно выше. В исследованиях A.Cormann (1981), T.Gys (1989), L.Israelson (1994), L.Carlson (1995) сравнивалось медленно абсорбируемые (PDS II или Maxon) с неабсорбируемыми (Prolen, Nurolon) непрерывными швами на 2669 пациентах. При мета-анализе этих исследований не выявлено значительных различий относительно частоты послеоперационной грыжи вне зависимости от использованного шовного материала. Тем не менее, установлено, что при использовании неабсорбируемых нитей частота случаев с длительными болью в ране и лигатурных свищей была достоверно выше по сравнению с медленно абсорбируемыми швами. При этом не выявлено разницы относительно частоты эвентрации, нагноения раны и формирования послеоперационных вентральных грыж. В последующие годы было проведено более 20 исследований по аналогичной проблематике. В результате 4 мета-анализов (D.Weiland, 1998; M.Hodgson, 2000; J.Rucinski, 2001; M.Van't Riet, 2002) было установлено, что статистически значимой разницы относительно частоты образования послеоперационной грыжи или расхождения раны при использовании медленно абсорбируемого и неабсорбируемого шовного материала нет. Напротив, данные как проспективных исследований, так и мета-анализов указывают, что при использовании неабсорбируемого шовного материала частота случаев стойких болевых ощущений в области послеоперационной раны и образования лигатурных свищей оказывается статистически выше [14,20,21,25,26,30,33].
Таким образом, приоритеты в выборе шовного материала для закрытия раны апоневроза следует расставить следующим образом: длительно абсорбируемые монофиламентные нити (PDS II, PDS Plus, Maxon) – неабсорбируемые монофиламентные нити (Prolen, Surgilen, Polypropilen, Novafil) – комплексные полифиламентные нити в оболочке (Ethibond, Surgidac, Ti-Cron).
Следует заметить, что существует ряд ситуаций, требующих обязательного применения только неабсорбируемого шовного материала. К таким ситуациям относится аллопластика грыжевых дефектов передней брюшной стенки с имплантацией в мышечно-апоневротический слой сетчатых протезов, фиксация которых осуществляется только полипропиленовыми нитями. Другой ситуацией является ушивание раны апоневроза у пациентов с прогнозируемой длительной репарацией тканей и замедлением созревания рубца: у истощенных и кахектичных больных, пациентов старческого возраста, у пациентов с распространенным онкопроцессом, при проведении периоперационной химиотерапии и лучевой терапии, при выполнении бариатрических процедур лапаротомным доступом. В данном случае целесообразным будет также применение неабсорбируемого шовного материала (монофиламентного или комплексного) [3,9,28].
Важный момент в выборе шовного материала для ушивания апоневроза – определение диаметра нити и соответствующего типа хирургической иглы. Как указывалось выше, к механическим причинам расхождения раны относятся разрыв шовной нити, развязывание (соскальзывание) узлов, прорезывание лигатурой тканей. Как правило, первые две причины встречаются относительно редко, расхождение раны возникает при прорезывании шовной нитью фасции брюшной стенки. При этом прочность шва закономерно повышается при увеличении их поперечного диаметра (0 – 4), но не столько за счет увеличения самой прочности нити, сколько за счет увеличения площади соприкосновения нити с тканью и, соответственно, уменьшения давления, оказываемого нитью на ткань. Поэтому при использовании шовных нитей с малым диаметром (2-0) вероятность прорезывания тканей при одинаковой силе затягивания закономерно выше. С другой стороны, при увеличении диаметра нити повышается травматичность ее проведения через ткань, увеличивается площадь стенок прокольного канала и, что самое главное, возрастает масса шовного материала, оставленного в тканях. Все это очевидно повышает вероятность возникновения инфекционного процесса в зоне наложенных швов.
В большинстве исследований, посвященных технике ушивания фасции и апоневроза, где применялась шовная нить размером 0 (USP) или выше, показано, что при использовании нити размера 1 частота эвентраций и послеоперационных вентральных грыж не была выше по сравнению с исследованиями, в которых хирурги применяли шовную нить большего размера, а именно 2 и 3. Таким образом, оптимальным размером хирургической нити, применяемой для шва апоневроза, является диапазон от 0 до 2 (максимум 3) по USP. Дальнейшее увеличение диаметра шовного материала не сопровождается увеличением прочности шва. Простым и очевидным способом увеличения прочности шва апоневроза является использование сдвоенной нити. При этом применяется нить размером 0 или даже 2-0. Удвоение нити увеличивает саму физическую прочность шовного материала (по аналогии с полифиламентом) и, что самое главное, за счет увеличения площади соприкосновения, уменьшает давление шовного материала на ткань. В настоящее время к использованию в клинической практике доступны атравматичные шовные материалы, где нить уже находится в виде петли (оба конца нити зажаты в тупом конце иглы). Для проведения нити через ткань апоневроза следует использовать атравматичные иглы в 3/8 окружности. Несмотря на то, что традиционно при ушивании апоневроза используются обычные режущие иглы, предпочтение следует отдавать использованию колюще-режущих (типа Tapercut) и обратно-режущих игл.
Техника шва апоневроза.
Принципиальным в закрытии операционной раны является методика ушивания фасциально-апоневротического слоя передней брюшной стенки. При этом отдельного обсуждения заслуживают как «этажность» соединения тканей (послойное или через все слои), так и способ формирования швов (отдельные или непрерывный). Не секрет, что хирурги, как правило, предпочитают технику ушивания брюшной стенки, которая считается приемлемой именно в данной клинике и соответствует ее традициям.
Послойное ушивание представляет собой метод, при котором отдельно сшивается каждый слой брюшной стенки, а именно брюшина и различимые мышечно-апоневротические слои (задний листок апоневроза, мышцы, передний листок апоневроза). При ушивании через все слои одновременно сшиваются все слои брюшной стенки (за исключением кожи и подкожно-жировой клетчатки) как единая структура, укрепленная в ряде случаев разгрузочными швами (рис. 4).
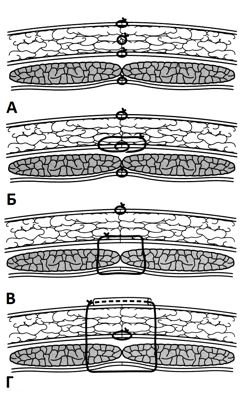 Рис. 4. Схематическое изображение вариантов ушивания апоневроза брюшной стенки: а – послойное; б – послойное со швами Smead-Johns; в – ушивание через все слои; г – ушивание через все слои с разгрузочными швами (J. De Lancey, R. Hartmann; 2008).
Рис. 4. Схематическое изображение вариантов ушивания апоневроза брюшной стенки: а – послойное; б – послойное со швами Smead-Johns; в – ушивание через все слои; г – ушивание через все слои с разгрузочными швами (J. De Lancey, R. Hartmann; 2008).
В прошлом было принято считать, что техника послойного ушивания, которая наиболее часто применяется практически при всех доступах, кроме верхне-срединной лапаротомии (подреберный доступ, парамедиальный доступ и т.д.), является наиболее приемлемой для создания адекватного и полноценного шва для раны. Сторонники послойного ушивания раны полагают, что достижением этого метода является то, что при его применении снижается частота случаев с образованием внутрибрюшинных спаек, которые способствуют снижению прочности раны, происходит точное сопоставление анатомических слоев, создается полная герметичность и изоляция раны от содержимого брюшной полости, обеспечивается хороший гемостаз, что в совокупности снижает вероятность расхождения краев раны.
В 1900 г. J. Smead первым описал технику ушивания через все слои отдельными двухъярусными швами. Повторное описание такой же техники в 1941 г. принадлежит W. Johnes, и впоследствии она была названа техникой Smead-Johnes (SJ) (рис. 5).
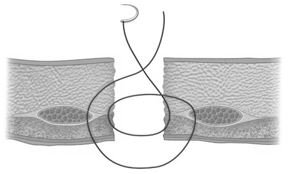 Рис. 5. Ушивание раны через все слои по методу Smead-Johnes (C.Posner et al., 2015).
Рис. 5. Ушивание раны через все слои по методу Smead-Johnes (C.Posner et al., 2015).
В экспериментальном исследовании H.Dudley, датируемым 1970 г., было продемонстрировано, что техника ушивания через все слои с помощью проволки из нержавеющей стали превосходит методику послойного ушивания тем же материалом. В 1975 г. J.Colligher поддержал концепцию ушивания через все слои неабсорбируемым материалом данными по частоте расхождения раны, которая равнялась 11% при послойном ушивании брюшной стенки в отличие от 1% при ушивании через все слои. В 1982 г. под руководством T.Bucknoll было выполнено проспективное исследование на 1129 пациентах при абломинальных оперативных вмешательствах, которое продемонстрировало, что при послойном ушивании частота эвентрации было значительно выше, нежели при ушивании через все слои (3,81% против 0,76%) [12].
Впоследствии, при накоплении материала сравнительных исследований, был сделали ряд выводов в пользу ушивания брюшной стенки через все слои. В частности, по данным R.Lewis (1989) и R.Chana (1993) при ушивании брюшины оказывается выше частота образования спаек, ухудшается сопоставление последующих слоев, и увеличивается продолжительность операции. В противоположность этому по данным большинства проспективных исследований разницы относительно частоты эвентрации или образования послеоперационных грыж при использовании обеих техник нет. Более того, уже упомянутые выше мета-анализы (D.Weiland, 1998; M.Hodgson, 2000; J.Rucinski, 2001; M.van't Riet, 2002; W. Hope, 2015) указывают на статистическую значимость снижения частоты случаев с образованием послеоперационных грыж и эвентрации при ушивании через все слои. Очевидным практическим преимуществом ушивания раны через все слои является меньшие временные затраты и минимально возможное количество шовного материала, оставляемого в ране [16,17,21,22,24,27,29,32].
Тем не менее, в ряде ситуаций даже хирурги, предпочитающие шов через все слои, выполняют послойное ушивание раны. Речь идет об оперативных доступах, при которых производится не пересечение, а расслоение мышц в плоскости, перпендикулярной рассечению листков апоневроза; типичный пример – косой переменный доступ в правой подвздошной области по Mc Burney – Волковичу – Дьяконову. Очевидно, что в данном случае сопоставить все анатомические структуры брюшной стенки можно лишь послойным ушиванием.
Следующий предмет обсуждения – приоритет одиночных узловых швов или непрерывного шва апоневроза. Сторонники непрерывного шва утверждают о том, что явными преимуществами этой техники наложения шва является то, что напряжение равномерно распределяется по всей длине разреза, что при ней выше показатель цена-эффект, а также требуется меньше времени и меньше шовного материала. Кроме того, G. Rodeheaver (1987) экспериментально продемонстрировал, что устойчивость к разрыву раны значительно выше при наложении хирургом непрерывного шва. При наложении непрерывного шва завязывается минимальное количество узлов, данная техника проще и быстрее в применении, чем при наложении отдельных швов, и, согласно результатам четырех вышеуказанных мета-анализов, наблюдается одинаковая или более низкая частота развития послеоперационных грыж и инфекции раны. Все данные утверждения справедливы и для непрерывного шва длительно абсорбируемым материалом, и для аналогичной техники при использовании неабсорбируемых нитей [2-4,8,9,27,32].
Единственным недостатком непрерывного шва, который рассматривается в теории, является то, что безопасность раны зависит лишь от материала одной шовной нити и ограниченного числа узлов: при разрыве нити или развязывании одного из двух узлов происходит расхождение раны по всей длине. Тем не менее, разрыв нити или развязывания узла при соблюдении должной техники работы с шовным материалом, по мнению большинства авторов, является редкой причиной расхождения раны. Для полного исключения подобных явлений рекомендуется применять шовный материал с анкерными свойствами (Stratafix, V-loc).
В попытках повышения надежности одиночных швов апоневроза хирурги часто прибегают к методикам формирования П-образных, 8-образных, Z-образных швов, швов типа Smеаd-Johnеs и т.п. R.Cleveland (1989), P.McNeill (1986), N.Hodgson (2000) на основании клинико-экспериментальных исследований пришли к заключению, что прочность ушитой раны не увеличивается, а частота эвентраций и послеоперационных грыж не снижается при использовании данных методик по сравнению с непрерывным обвивным швом. Аналогично этому никаких преимуществ в плане непосредственных и отдаленных результатов операции не дает применение усложненных вариантов непрерывного шва (непрерывный П-образный, Шмидена, Ревердена, Мультановского) по сравнению со стандартным обвивным швом.
В настоящее время широкое распространение получила методика формирования непрерывного шва апоневроза сдвоенной нитью. В дизайне сдвоенной нити в виде петли, закрепленной в атравматичную иглу, выпускаются используется шовный материал PDS II, PDS Plus, Monomax, Maxon, Novafil. К преимуществам работы таким шовным материалом (помимо легкости проведения через ткань за счет монофиламентности) относятся: удвоенная прочность нити, сниженное давление на ткань, легкая безузловая фиксация нити после первого вкола-выкола с помощью петли и необходимость формирования только одного узла (естественно, многопетлевого) при завершении наложения шва (рис. 6).
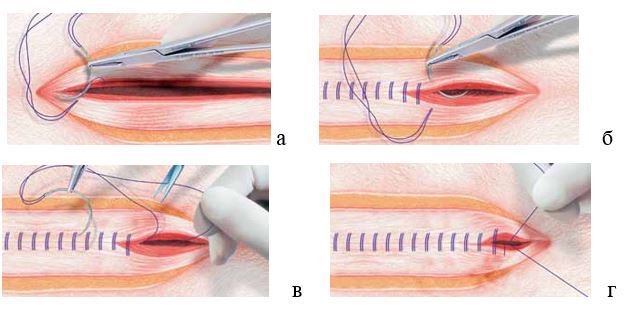 Рис. 6. Закрытие срединной лапаротомной раны непрерывным швом через все слои сдвоенной нитью-петлей (а-г – последовательность этапов).
Рис. 6. Закрытие срединной лапаротомной раны непрерывным швом через все слои сдвоенной нитью-петлей (а-г – последовательность этапов).
При формировании непрерывного шва важным моментом является выбор оптимального расстояния между стежками. С одной стороны стежки должны быть достаточно частыми для обеспечения надежной аппозиции и иммобилизации краев раны, определяя ее механическую прочность в раннем послеоперационном периоде. С другой стороны чрезмерная частота стежков может способствовать ишемизации краев апоневроза и закономерно увеличивает массу оставленного в тканях шовного материала.
Для определения необходимого и достаточного промежутка между стежками и расстояния от края апоневроза до места вкола самым простым способом будет определение длины нити, необходимой для ушивания раны. При этом следует учитывать, что длина разреза при срединной лапаротомии может увеличиваться до 30% в послеоперационный период под действием нескольких факторов, которые в конечном счете способствуют повышению внтурибрюшного давления. Если размер стежка, который выбран при ушивании (и связанная с ним длина нити, которая применяется хирургом) не достаточно длинный, чтобы выдержать нагрузку при предполагаемом удлинении раны, то в этом случае шовная нить прорезывает фасцию, что приводит к расхождению краев раны.
В двух независимых клинико-экспериментальных исследованиях T.Jenkins (1976) и L.Israelsson (1993) с помощью геометрических расчетов и правил, которые применяются к сторонам треугольника, исследовалась взаимосвязь между стежками прошиваемой ткани и количеством шовного материала, который использует хирург. В результате был сделан вывод о том, что длину стежка в прошиваемой ткани, при котором шов не будет прорезываться, можно выразить с помощью длины шовного материала, необходимой для ушивания рассматриваемого разреза. В исследованиях было установлено, что при соотношении «длина шва/ длина раны» 4/1 можно накладывать достаточно крупные стежки на прошиваемой ткани, причем шов не прорезывается даже при максимальном удлинении разреза в послеоперационном периоде. При этом соотношение 4/1 получается при накладывании швов приблизительно 1 см от края апоневроза и приблизительно 1 см друг от друга (рис. 7.13). В ходе клинических наблюдений S. Varshney et al. (1997), D. Millbourn (2012) и E. Deerenberg et al. (2015) также сделали вывод о том, что соотношение длины шва к длине раны от 4/1 до 6/1 с уменьшением расстояния от края раны до вкола и между швами до 0,5 см приводит к значительному снижению частоты эвентраций и послеоперационных грыж [9,10,15,21,23,24,28].
Известно, что «ахиллесовой пятой» непрерывного шва является фиксация нити всего двумя узлами. С учетом того, что прочность нити теряется прежде всего в узле и потеря прочности зависит как от свойств шовного материала, так и от степени мануальных навыков хирурга. L. Israelsson et al. (2015) экспериментально доказали, что при использовании фиксирующих непрерывный шов самозатягивающихся узлов тратится меньшее количество нити и узел выдерживает большее усилие на разрыв. Если в стандартном (квадратном) узле нить теряет до 40% исходной прочности, то при наложении петлевого – только до 10% от исходной прочности. При этом автор рекомендует разные узлы для начала и конца непрерывного шва: в начале шва – узел Roeder, в конце шва конец – узел Aberdeen (рис. 7).
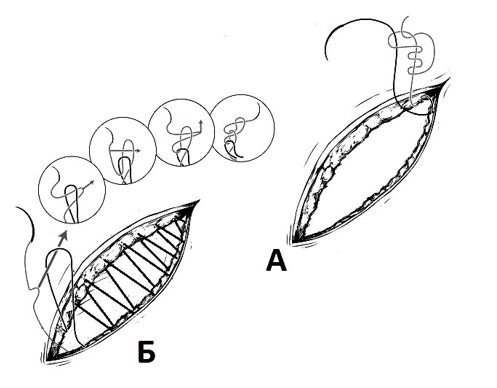 Рис. 7. Методика фиксации непрерывной нити при шве апоневроза узлами Roeder (а) и Aberdeen (б).
Рис. 7. Методика фиксации непрерывной нити при шве апоневроза узлами Roeder (а) и Aberdeen (б).
Таким образом, оптимальной техникой закрытия операционной раны, при которой снижается частота эвентраций и послеоперационных грыж, является ушивание через все слои обвивным непрерывным швом медленно абсорбируемой монофиламентной нитью (при предполагаемых нарушениях репаративных процессов – неабсорбируемой монофиламентной или комплексной нитью) с техникой «small bites - малых стежков» при соотношении длины шовного материала к длине раны 6/1 – 4/1. При закрытии раны после контаминированных или инфицированных операций целесообразно использование медленно абсорбируемой нити с антисептическим покрытием – PDS Plus. «Шить непрерывными стежками момнофиламентной нитью через все слои, к тому же без натяжения, - вот рецепт того, как избежать расхождения раны и эвентрации», - указывает известный американский хирург Moshe Schein.
Закрытие троакарных ран.
Профилактике вентральных грыж после лапароскопических операций уделяется несравненно меньше внимания, чем аналогичной проблеме при лапаротомных доступах. Между тем уже в 1968 г. R. Fear первым сообщил о случае появления послеоперационной грыжи в месте установки троакара после лапароскопии. По данным литературы, осложнения, связанные с использованием троакара, возникают приблизительно у 1-6% пациентов [7]. Прогрессивный рост числа лапароскопических оперативных вмешательств и соответствующее увеличение потенциально возможных троакарных грыж определяют необходимость применения специальных мероприятий для предупреждения этого осложнения. Необходимо отметить, что, несмотря на исходно малые размеры дефекта апоневроза, в троакарных грыжах вполне может развиться ущемление пряди сальника или ущемление кишки (рис. 8).
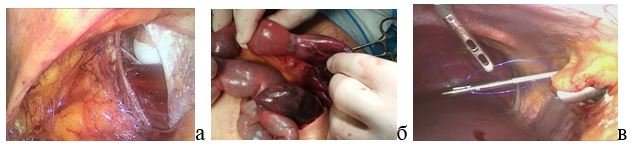 Рис. 8. Проблема троакарных грыж и варианты ее решения: а – дефект передней брюшной стенки после расширения 10-мм троакарной раны; б – ущемление тонкой кишки в троакарной ране; в – вариант ушивания троакарной раны.
Рис. 8. Проблема троакарных грыж и варианты ее решения: а – дефект передней брюшной стенки после расширения 10-мм троакарной раны; б – ущемление тонкой кишки в троакарной ране; в – вариант ушивания троакарной раны.
Троакарными грыжи возникают в местах установки 10-ти, 12-ти и 13-ти миллиметровых троакаров. Вероятность возникновения грыжи увеличивается при использовании лепестковых или иных расширителей для извлечения препарата. Закрытие троакарных ран является отдельной и подчас не совсем простой задачей. Вследствие недостаточного кожного разреза стандартные методы «шва снаружи» с использованием нити и иглы могут быть технически трудны, а отсутствие визуального контроля часто влечет за собой неконтролируемое и как следствие неадекватное закрытие дефекта. В настоящее время разработаны специальные методы и устройства, призванные минимизировать риск формирования грыжи и облегчить хирургу этап закрытия троакарной раны. Самым простым и популярным устройством является игла для ушивания троакарных ран. Шовный материал захватывается браншами иглы и под визуальным эндоскопическим контролем проводится через все подкожные слои в брюшную полость. Затем шовный материал захватывается зажимом и высвобождается из иглы. Игла без шовного материала повторно вводится в брюшную полость в месте, противоположном месту первого вкола. Шовный материал подается зажимом и захватывается браншами иглы. Игла вместе с нитью извлекается, при этом нить протягивается через все слои тканей брюшной стенки. Узел формируется снаружи.
Временное закрытие лапаротомной раны при перитоните.
В неотложной абдоминальной хирургии нередки ситуации, когда живот не может быть закрыт или не должен быть закрыт – при операциях у пациентов с распространенным гнойным перитонитом. Вторая, менее распространённая ситуация - эвентрация в гнойную рану. Очевидно, что во многих случаях речь идет об одних и тех же пациентах, поскольку частота нагноения ран при перитоните достигает 30% - 70%, а среди причин развития эвентрации послеоперационный перитонит занимает ведущее место [1,5,11].
В настоящее время основным трендом ведения пациентов с распространенным гнойным перитонитом и эвентрацией в гнойную рану является методика «открытого живота» (лапаростомия, этапные санации) с применением VAC-систем. Несмотря на прогрессивность концепции, методика «открытого живота» обладает одним существенным недостатком. Для предупреждения возникновения компартмент-синдрома края апоневроза операционной раны в процессе лечения по данной методике не сводятся. В течение весьма короткого временного промежутка дефект брюшной стенки будет постепенно увеличиваться, вследствие расхождения краев апоневроза под воздействием тракции боковых мышц брюшной стенки. В итоге это приводит к значительному диастазу краев апонероза, создающему значительное натяжение при заключительном ушивании раны или делающему ушивание апоневроза вообще невозможным.
С целью предупреждения прогрессирования диастаза применяется техника «медиализации» краев прямых мышц живота. Для этого по окончанию первой операции к краям апоневроза по всей окружности непрерывным швом фиксируют полипропиленовую сетку с первичным диастазом краев апоневроза шириной 10 – 15 см. Под сетку до момента ее фиксации укладывают неадгезивную перфорированную мембрану, на сетку помещают губку, рану герметизируют покровной пленкой и подключают к VAC-системе. При последующих санациях брюшной полости сетку рассекают по центру, производят манипуляции и далее рассеченные края сетки вновь сшивают постепенно сближая края апоневроза. В ходе этапных санаций постепенно удается уменьшить ширину диастаза, а при разрешении перитонита сетку удаляют и ушивают апоневроз (рис. 9).
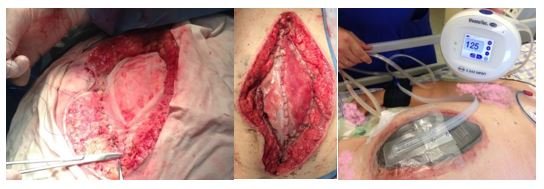 Рис. 9. Техника медиализации краев апоневроза при использовании методики «открытого» живота с применением VAC-систем у пациентов с распространенным перитонитом.
Рис. 9. Техника медиализации краев апоневроза при использовании методики «открытого» живота с применением VAC-систем у пациентов с распространенным перитонитом.
В заключение следует еще раз подчеркнуть, что, несмотря на известные в настоящее время объективные факторы нарушения раневой репарации и развития ранней или поздней несостоятельности апоневротических швов, именно «хирург является основным фактором осложнений лапаротомии» (Israelson L.A., 2015). В этой связи очевидно, что именно методологически и технически правильно сформированный шов апоневроза передней брюшной стенки является ключевым моментом в профилактике развития эвентраций и послеоперационных вентральных грыж.
Список литературы:
1. Баранов А.И., Лещишин Я.М., Атаманов К.В. Лапаростомия: история развития и технические аспекты выполнения. Сибирское медицинское обозрение, 2018.-N 3.-С. 34-42. [Baranov AI, Leshсhishin YM, Atamanov KV, Martynov AA, Potehin KV. Laparostomia: history of development and technical aspects of implementation. Siberian Medical Review. 2018;(3): 34-42] DOI: 10.20333/2500136-2018-3-34-42
2. Буянов В.М., Егиев В.Н., Удотов О.А. Хирургический шов. М., 1993, 104 с. [Buyanov V.M., Egiev V.N., Udotov O.A. Surgical suture. M., 1993, 104 p].
3. Гостищев В.К., Бояринцев В.В., Евсеев М.А. Технологии соединения тканей в абдоминальной хирургии. Руководство для врачей. М., 2019, 309 с. [Gostishchev V.K., Boyarintsev V.V., Evseev M.A. Compounds tissues technologies in abdominal surgery. Guidans for doctors. M., 2019, 309 p]. ISBN 978-5-6042825-4-0.
4. Гостищев В.К., Евсеев М.А. Нить плюс игла. Шовный материал в общехирургической практике. М., 2012, 186 с. [Gostishchev V.K., Evseev M.A. Thread plus needle. Suture material in general surgical practice. M., 2012, 186 p] ISBN 978-5-905263-04-0.
5. Ермолов А.С., Корошвили В.Т., Благовестнов Д.А. Послеоперационные вентральные грыжи — нерешенные вопросы хирургической тактики. Хирургия, 2018.-N 10.-С.81-86 [Ermolov AS, Blagovestnov DA, Alekseev AK, Upyrev AV, Yartsev PA, Shlyakhovskiy IA, Koroshvili VT, Burbu AV. Optimized approach to the surgical treatment of patients with large and giant postoperative ventral hernia. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im.N.I. Pirogova. 2019;9:38-43. (In Russ.)] doi.org/10.17116/hirurgia201909138.
6. Лазаренко В.А., Иванов С.В., Иванов И.С. Соотношение типов коллагена в прогнозировании послеоперационных вентральных грыж. Хирургия, 2017.-N 6.-С.33-36. [Lazarenko V.A., Ivanov S.V., Ivanov I.S., Rosberg E.P., Tsukanov A.V., Popova L.P., Tarabrin D.V., Obyedkov E.G. Collagen types ratio in prediction of postoperative ventral hernias. Khirurgiya. Zhurnal im. N.I. Pirogova. 2017; (6): 33-36 (in Russ.)] DOI: 10.17116/hirurgia2017633-36.
7. Праздников Э.Н., Баранов Г.А., Сидоров В.В. Риски осложнений троакарных ран при лапароскопической холецистэктомии. Хирург, 2019.-N 1-2.-С.3-9 [E.N. Prazdnikov, G.A. Baranov, V.V. Sidorov Risks of complications of trocar wounds in laparoscopic cholecystectomy. Surgeon, 2019.-N 1-2.-С.3-9].
8. Савостьянов И.В., Данильченко И.Ю., Лещишин Я.М. Пространственные характеристики поперечной лапаротомии. сравнение анатомических и рентгенологических результатов. Казанский медицинский журнал, 2019.-N 2.-С.351-357 [Savostyanov I.V., Danilchenko I.Yu., Leshchishin Ya.M. Spatial characteristics of transverse laparotomy. comparison of anatomical and radiological results. Kazan Medical Journal, 2019.-N 2.-С.351-357] doi.org/10.17816/KMJ_1002.
9. Самарцев В.А., Гаврилов В.А. Ушивание срединных лапаротомных ран. Современное состояние проблемы. Хирургическая практика, 2015, №1, 10-15. [Samartsev V.A., Gavrilov V.A. Suturing of midline laparotomic wounds. Current state of the problem. Surgical practice, 2015, No. 1, 10-15] doi.org/10.38181/2223-2427-2015-2-50-55.
10. Abdelsamie M., Abd El Shahid M. Evaluation of a new technique for abdominal wall closure in midline laparotomies. Int Surg J. 2018 Aug;5(8):2701-2707. dx.doi.org/10.18203/2349-2902.isj20183188.
11. Alexander HC, Prudden JF. The causes of abdominal wound disruption. Surg Gynecol Obstet. 1966;122:1223–1229. PMID: 5328836.
12. Bucknall TE, Teare L, Ellis H. The choice of suture to close abdominal incisions. Eur Surg Res. 1983;15:59-66. doi: 10.1159/000128334.
13. Cameron AE, Gray RC, Talbot RW, Wyatt AP. Abdominal wound closure: a trial of Prolene and Dexon. Br J Surg 1980; 67: 487-8. doi: 10.1002/bjs.1800670712.
14. Carlson MA, Condon RE. Polyglyconate (Maxon) versus nylon suture in midline abdominal incision closure: a pro¬spective randomized trial. Am J Surg. 1995;61:980-983. PMID: 7486431.
15. Deerenberg EB, Harlaar JJ, Steyerberg EW, et al. Small bites versus large bites for closure of abdominal midline incisions (STITCH): a double-blind, multicentre, randomised controlled trial. The Lancet. 2015, 5(65), 34-43. doi: 10.1016/S0140-6736(15)60459-7.
16. Diener MK, Voss S, Jensen K, Buchler MW, Seiler CM. Elective midline laparotomy closure: the INLINE systematic review and meta-analysis. Ann Surg. 2010;251:843–856. doi: 10.1097/SLA.
17. Douglas DM. The healing of aponeurotic incisions. Br J Surg. 1952;40:79-84. DOI: 10.1002/bjs.18004015918.
18. Ellis H, George CD. Incisional hernias: when do they occur? Br J Surg 1983; 70: 290-1. doi: 10.1002/bjs.1800700514.
19. Franz M. The Biology of Hernia Formation. Surg Clin North Am. 2008, Feb; 88(1). doi: 10.1016/j.suc.2007.10.007.
20. Gys Т, Hubens A. A prospective comparative clinical study between monofilament absorbable and nonabsorb¬able sutures for abdominal wall closure. Acta Chir Belg. 2009;89:265-270. PMID: 2530745.
21. Hodgson NCF, Malthaner RA, Ostbye T. The search for an ideal method of abdominal fascial closure: a meta-analysis. Ann Surg 2000; 231: 436-42. doi: 10.1097/00000658-200003000-00018.
22. Israelsson L, Millbourn D. Prevention of incisional hernias: how to close a midline incision. Surg Clin North Am. 2013;93:1027–1040. DOI:10.1016/j.suc.2013.06.009
23. Israelsson LA. Abdominal incision closure: small but important bites. Lancet. Epub 2015 Jul 15. doi: 10.1016/S0140-6736(15)60687-0.
24. Kendall SWH, Brennan TG, Guillou PJ. Suture strength to wound length ratio and the integrity of midline and lateral paramedian incisions. Br jsurg. 1991;78:705-707. doi: 10.1002/bjs.1800780623.
25. Krukowski ZH, Cusick EL, Engeset J, Matheson NA. Polydioxanone or polypropylene for closure of midline abdominal incisions: a prospective comparative clinical trial. Br jsurg. 2007;74:828-830. DOI: 10.1002/bjs.1800740927.
26. Leaper DJ, Allan A, May RE, Corfield AP, Kennedy RH. Abdominal wound closure: a controlled trial of polyamide (nylon) and polydioxanone suture (PDS). Annr Coll Surg Engl 1985; 67: 273-5. PMID: 3931536.
27. Moharam Abdelsamie Mohamed Abd El Shahid, Fawzy Abo Bakre Mahmoud, A. Said Elmallah. Evaluation of a new technique for abdominal wall closure in midline laparotomies. Int Surg J. 2018 Aug;5(8):2701-2707. DOI:10.18203/2349-2902.isj20183188.
28. Muysoms FE, et al. European Hernia Society guidelines on the closure of abdominal wall incisions. Hernia. 2015;19(1):1–24. doi: 10.1007/s10029-014-1342-5.
29. Richards PC, Balch CM, Aldrete JS. Abdominal wound closure. A randomized prospective study of 571 patients comparing continuous vs. Interrupted suture techniques. Ann Surg. 1983;197:238-243. doi: 10.1097/00000658-198302000-00018.
30. Sahlin S, Ahlberg J, Grantstrom L, Ljungstrom KG. Monofilament versus multifilament absorbable sutures for abdominal closure. Br jsurg. 1993;80:322-324. doi: 10.1002/bjs.1800800318.
31. Seiler CM, Bruckner T. et al. Interrupted or Continuous Slowly Absorbable Sutures For Closure of Primary Elective Midline Abdominal Incisions. Annals of Surgery Vol 249, N4 April 2009; 576–582. doi: 10.1097/SLA.0b013e31819ec6c8.
32. Wadstrom J, Gerdin B. Closure of the abdominal wall: how and why? Acta Chir Scand. 1999;156:75-82. PMID: 2181798.
33. Williams Z., Hope W. Abdominal wound closure: current perspectives. Open Access Surgery 2015:8 89–92. doi.org/10.2147/OAS.S60958.





